Перечень 19 нозологий
- Методология /
-
4757
В 2012 г. вступил в силу Федеральный закон РФ № 323-ФЗ, в котором в статье 44 был определён статус редких (орфанных) заболеваний – заболевания с распространённостью не более 10 случаев на 100 000 населения, а также определены полномочия органов государственной власти субъектов РФ в сфере охраны здоровья, среди которых организация обеспечения граждан ЛП и специализированными продуктами лечебного питания для лечения редких заболеваний. Обеспечение граждан ЛП для лечения заболеваний, включённых в Перечень жизнеугрожающих и хронических прогрессирующих редких (орфанных) заболеваний, является расходным обязательством бюджетов субъектов РФ [1].
В 2012 г. вышло постановление Правительства РФ № 403, в котором детализирован порядок ведения федерального и региональных регистров лиц, страдающих редкими (орфанными) заболеваниями [2], и сформирован ещё один ограничительный перечень – Перечень жизнеугрожающих и хронически прогрессирующих редких (орфанных) заболеваний, приводящих к сокращению продолжительности жизни граждан или их инвалидности.
На сегодняшний день Перечень редких заболеваний (ранее из 24, а с переносом 5 нозологий в Перечень 7 ВЗН сократился до 19) состоит из 19 групп болезней согласно Международной классификации болезней 10-го пересмотра (МКБ-10) (далее – «Перечень 19 нозологий»). Полный перечень зарегистрированных орфанных заболеваний в РФ размещается на официальном сайте rosminzdrav.ru [3]. Поскольку Перечень составлялся несколько лет назад и число заболеваний, для которых разработано патогенетическое лечение, увеличилось, то сегодня он должен содержать не менее 30 нозологий.
В 2014 г. Федеральным законом от 22.12.2014 г. № 429-ФЗ в статью 4 Федерального закона от 12.04.2010 г. № 61-ФЗ было введено понятие «орфанные лекарственные препараты» – лекарственные препараты, предназначенные исключительно для диагностики или патогенетического лечения (лечения, направленного на механизм развития заболевания) редких (орфанных) заболеваний [4].
Ввиду того, что для ряда субъектов РФ нет возможности обеспечить адекватное финансирование Перечня 19 нозологий за счёт собственных средств, с 2015 г. в отношении этой программы дополнительно предусмотрено федеральное финансирование.
Если у пациента диагностировано и лабораторно подтверждено редкое заболевание из Перечня 19 нозологий, то больной должен быть занесён в региональный сегмент Федерального регистра лиц, страдающих жизнеугрожающими и хроническими заболеваниями (как и для «12 ВЗН») [2]. Этот этап является обязательным. За внесение данных в регистр несут ответственность назначенные сотрудники лечебно-профилактического учреждения (ЛПУ), где этот пациент наблюдается (см. рис. 1) [5].
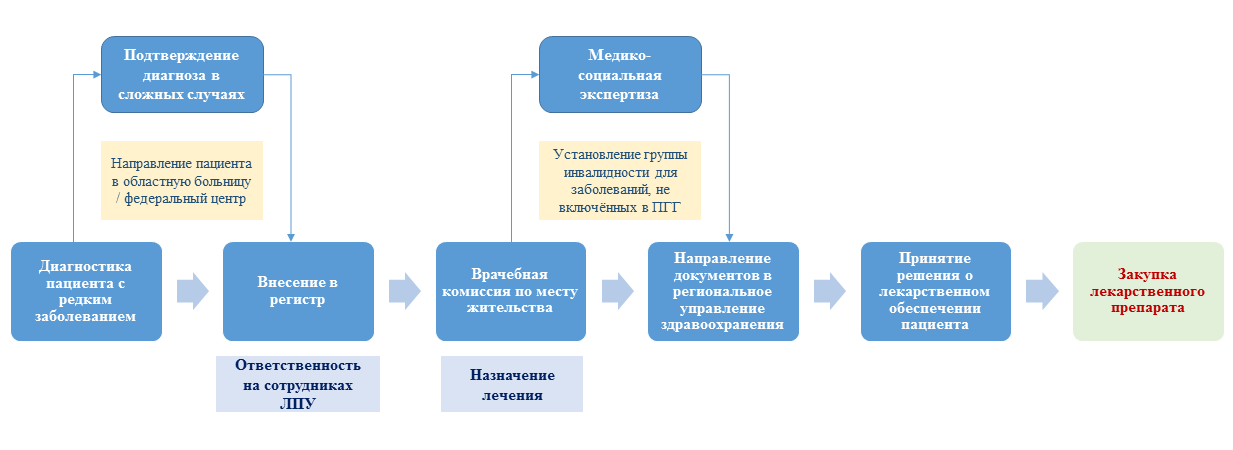
Рис. 1. Порядок ведения пациента с редким заболеванием
В случае невозможности проведения врачебного консилиума по месту жительства пациента по причине отсутствия в штате ЛПУ необходимых специалистов или необходимого оборудования, пациент может быть направлен в специализированные отделения медицинской организации (например, в областную или республиканскую клиническую больницу) или в другую медицинскую организацию (например, федеральный центр) для решения вопросов, связанных с состоянием его здоровья, диагнозом, определением прогноза и тактики его лечения [5].
Госпитализация пациента в другую медицинскую организацию (например, федеральный центр) возможна как с использованием региональных квот, так и за счёт средств программы высокотехнологичной медицинской помощи [5].
После занесения данных пациента в региональный сегмент Федерального регистра и/или получения протокола врачебного консилиума федерального центра лечащий врач инициирует проведение врачебной комиссии для диагностики и назначения ЛП для последующего лечения [5] (приказ Министерства здравоохранения и социального развития России от 05.05.2012 г. № 502н «Об утверждении порядка создания и деятельности врачебной комиссии медицинской организации» [6]).
Следующим этапом является направление документов в региональное управление здравоохранения. Данный список включает следующие документы: протокол заседания врачебной комиссии, заключение врачебного консилиума федерального центра (если таковое имеется), заключение медико-социальной экспертизы (если таковое имеется) и заявку на лекарственное обеспечение пациента [5].
В некоторых случаях, если пациент страдает заболеванием, не включённым в федеральную или ТПГГ, необходимо проведение медико-социальной экспертизы с установлением группы инвалидности [5].
После поступления в региональное управление здравоохранения всех вышеперечисленных документов принимается решение о лекарственном обеспечении пациента [5]. В случае положительного решения происходит закупка ЛП в рамках действующего законодательства (Федеральный закон РФ № 223 или 44) [5, 7, 8].
_________
Источник: Включение лекарственных препаратов в ограничительные перечни: пошаговый алгоритм / под общ. ред. Белоусова Д. Ю., Зырянова С. К., Колбина А. С. — М. : Издательство ОКИ : Буки Веди, 2019. — 252 с. : ил. ISBN 978-5-4465-2555-3. https://clck.ru/MBP84
_________
Литература
- Федеральный закон от 21.11.2011 № 323-ФЗ (ред. от 03.07.2016) «Об основах охраны здоровья граждан в Российской Федерации» (с изм. и доп., вступ. в силу с 01.01.2017) [Электронный ресурс]. – Режим доступа: https://clck.ru/DNwu9
- Постановление Правительства РФ от 26.04.2012 № 403 (ред. от 04.09.2012) «О порядке ведения Федерального регистра лиц, страдающих жизнеугрожающими и хроническими прогрессирующими редкими (орфанными) заболеваниями, приводящими к сокращению продолжительности жизни граждан или их инвалидности, и его регионального сегмента» (вместе с Правилами ведения Федерального регистра лиц, страдающих жизнеугрожающими и хроническими прогрессирующими редкими (орфанными) заболеваниями, приводящими к сокращению продолжительности жизни граждан или их инвалидности, и его регионального сегмента) [Электронный ресурс]. – Режим доступа: https://clck.ru/HXtQY
- Перечень редких (орфанных) заболеваний от 04.02.2019 [Электронный ресурс]. – Режим доступа: https://clck.ru/Fneaq
- Федеральный закон от 12.04.2010 № 61-ФЗ «Об обращении лекарственных средств» (с изм. и доп., вступ. в силу с 01.01.2017) [Электронный ресурс]. – Режим доступа: https://clck.ru/HXtEH
- Куцев С. И. Путь пациента с редким диагнозом: нормативные документы и организация лечебно-диагностического процесса при орфанном заболевании в Российской Федерации [Электронный ресурс] // Нервно-мышечные болезни. – 2017. – Т. 7. – № 4. – С. 61–63. DOI: 10.17650/2222-8721-2017-7-4-61-63. – Режим доступа: https://clck.ru/GLEGW
- Приказ Министерства здравоохранения и социального развития РФ от 05.05.2012 № 502н «Об утверждении порядка создания и деятельности врачебной комиссии медицинской организации» [Электронный ресурс]. – Режим доступа: https://clck.ru/GLEhN
- Федеральный закон от 18.07.2011 № 223-ФЗ «О закупках товаров, работ, услуг отдельными видами юридических лиц» (с изм. и доп. от 01.05.2019) [Электронный ресурс]. – Режим доступа: https://clck.ru/GLEmi
- Федеральный закон от 05.04.2013 № 44-ФЗ «О контрактной системе в сфере закупок товаров, работ, услуг для обеспечения государственных и муниципальных нужд» (с изм. и доп. от 01.05.2019) [Электронный ресурс]. – Режим доступа: https://clck.ru/GLEox
.png)