Фармакоэкономические аспекты эффективности ингибиторов ангиотензипревращающего фермента при артериальной гипертонии и сердечной недостаточности

- Библиотека /
-
6367
В последние годы резкое увеличение расходов на здравоохранение поставило новые задачи – определение фармакоэкономических преимуществ различных методов диагностики и лечения. Появились альтернативные методы терапии, большое количество новых дорогостоящих медицинских технологий, лекарственных препаратов, повысилась стоимость медицинских услуг, однако количество денежных средств, выделяемых на здравоохранение, по–прежнему ограничено. Поэтому и среди организаторов здравоохранения, и среди практических врачей возрос интерес к проблемам экономической оценки эффективности лечения различных заболеваний.
Экономическая оценка эффективности определенной медицинской программы или метода лечения в целом представляет собой соотношение затрат на их проведение и их эффективности, включая в себя прямые и непрямые «затраты». Прямые затраты состоят из прямых медицинских и прямых немедицинских затрат. Прямые медицинские затраты включают стоимость оборудования и лекарственных средств, стационарного лечения, визитов к врачам, вызовов скорой медицинской помощи, затраты на коррекцию побочных эффектов и лечение сопутствующих заболеваний. Прямые немедицинские затраты объединяют расходы на транспортировку, питание, обслуживающий персонал и др.
Более сложным представляется учет непрямых затрат, таких как потеря дохода для семьи, снижение производительности для общества, ухудшение качества жизни (КЖ) и др. Выделяют три вида непрямых затрат. Первый – непрямые затраты, связанные с заболеванием (morbidity costs), – включает товары и услуги, не произведенные и не оказанные пациентом вследствие заболевания. Второй – затраты, связанные со смертью (mortality costs) – включает товары и услуги, которые пациент мог произвести и оказать, если бы болезнь была излечена и пациент не умер преждевременно. Третий вид непрямых затрат обусловлен потерей продуктивности работающего человека, вынужденного покинуть рабочее место для оказания поддержки больного, обычно члена своей семьи.
Существуют различные подходы к определению критериев эффективности того или иного вида лечения – экономия денежных средств, увеличение продолжительности жизни и улучшение ее качества, а также получение прямой экономической прибыли. Наиболее часто экономическая эффективность лечения выражается стоимостью одного продленного года жизни (cost per life–year gained) или стоимостью года лечения, включая госпитализацию, диализ и т.д.
Используют несколько методов экономического анализа эффективности медицинских вмешательств: анализ минимизации стоимости (cost miniminization analisis), анализ эффективности затрат или стоимостной анализ эффективности (cost effectiveness analisis), стоимостно–утилитарный анализ или анализ эффективности затрат в утилитарных единицах (cost utiliti analisis), стоимостный анализ прибыли (cost benefit analisis).
Из существующих 4–х методов экономического анализа эффективности медицинских вмешательств (анализ минимизации стоимости, анализ эффективности затрат, стоимостной анализ прибыли, анализ эффективности затрат в утилитарных единицах) в связи с рядом преимуществ наиболее предпочтителен анализ эффективности затрат в утилитарных единицах. В качестве общей единицы измерения в данном случае используют годы качественной жизни (QALY).
Оценка экономической эффективности лечения АГ, – одного из самых распространенных заболеваний сердечно–сосудистой системы (ее частота у лиц пожилого и старческого возраста превышает 70%) вполне закономерно ставит ее в число наиболее актуальных проблем фармакоэкономики в кардиологии. Кроме того, хотя сама АГ не вызывает существенного ухудшения КЖ и работоспособности, она является основным фактором риска развития ряда серьезных сердечно–сосудистых осложнений (прежде всего инфаркта миокарда и инсульта), лечение которых требует больших денежных затрат. Так, в США в год происходит около 500000 инсультов, примерно в половине случаев которых причиной является АГ. Общая стоимость лечения инсультов, связанных с АГ, составляет 26 млрд. долларов. В то же время стоимость гипотензивной терапии составляет 17 млрд долларов в год. Если учесть, что гипотензивная терапия снижает риск развития инсульта на 40%, то очевиден вывод: положительная экономическая эффективность от проводимой гипотензивной терапии составляет около 10,5 млрд долларов.
В структуре затрат на лечение АГ в США затраты на госпитализацию составляют 30% (4,7 млрд долларов), затраты на гипотензивные препараты – 20% (4 млрд долларов). В Италии (Great study) затраты на гипотензивные медикаменты достигают 56%. Поэтому выбор оптимального с точки зрения не только клинической, но и фармакоэкономической эффективности, гипотензивного препарата – одна из важнейших медицинских и социальных задач.
Выделена группа факторов, определяющих экономическую эффективность лечения АГ. Прежде всего на рентабельность гипотензивной терапии оказывает влияние исходный уровень диастолического АД. Так, по данным B.G. Jonsson, стоимость одного года спасенной жизни (т.е. экономическая эффективность гипотензивной терапии) при лечении АГ возрастает при исходно более высоком уровне диастолического АД.
Другим фактором, влияющим на рентабельность гипотензивной терапии, является возраст больных: стоимость лечения АГ на один QALY снижается с возрастом, отражая доказанную способность гипотензивной терапии предотвращать ее осложнения у пожилых пациентов. Другими словами, отмечена более выраженная экономическая эффективность лечения АГ у пациентов среднего и пожилого возраста.
Использование суточного мониторирования АД у всех больных АГ перед началом медикаментозного лечения в одном исследовании позволило исключить лиц с гипертонией «белого халата» (их популяционная частота достигает 21%), которые не нуждаются в гипотензивной терапии, и таким образом сэкономить 110000 $.
Важным фактором, влияющим на экономическую эффективность гипотензивной терапии, является приверженность к лечению, т.е. степень, с которой реальный режим приема препарата соответствует предписанному. Подсчитано, что в США 11,7% всех расходов на здравоохранение тратится на оплату госпитализаций, обусловленных низкой приверженностью больных к предписанной терапии.
К факторам, повышающим приверженность к лечению, относят исходно высокий уровень АД, женский пол, высокий уровень образования, более высокий уровень дохода, состояние в браке, высокий уровень культуры, применение фиксированных комбинированных препаратов. Среди факторов, снижающих приверженность, имеют значение сложный режим дозирования препаратов, побочные эффекты, высокая цена, быстрое снижение АД, курение, молодой возраст, длительное лечение, злоупотребление алкоголем, низкий уровень культуры.
Кратность приема препарата – очень важный фактор, влияющий на приверженность. Установлено, что при двухкратном режиме дозирования (утро–вечер) приверженность к лечению уменьшается в 5 раз по сравнению с однократным приемом. Поэтому в лечении больных с сердечно-сосудистыми заболеваниями приоритет в настоящее время отдан препаратам пролонгированного действия. Среди ингибиторов АПФ – это лизиноприл, квинаприл, периндоприл, фозиноприл.
На приверженность к лечению влияет и класс гипотензивных медикаментов, который был выбран в качестве терапии первого выбора (рис. 1). Показано, что максимальная приверженность к лечению отмечена в тех случаях, когда в качестве препаратов первого выбора использовались ингибиторы АПФ.

Рис. 1. Комплаентность к первому назначенному антигипертензивному препарату
Фармакоэкономические преимущества того, либо иного препарата вообще и ингибиторов АПФ, в частности, сильно зависят от его безопасности – т.е. частоты побочных эффектов. Во–первых, затраты на коррекцию побочных эффектов (в том числе и стоимость госпитализаций, связанных с обострением сопутствующих заболеваний) входят в общую стоимость лечения и увеличивают ее в 1,89 раза, т.е. почти вдвое. Во–вторых, появление побочных эффектов резко снижает приверженность больных к лечению.
Одним из основных факторов, обусловливающих рентабельность применения конкретного гипотензивного препарата, является его цена. Хотя определение стоимости гипотензивных медикаментов является достаточно простой задачей, она осложняется тем, что в каждой группе препаратов имеется значительный диапазон цен.
Бурное развитие фармацевтического рынка привело к появлению на нем большого числа воспроизведенных, или так называемых генерических препаратов, обладающих биоэквивалентностью и меньшей стоимостью по отношению к оригинальному препарату. Зачастую существенные отличия у этих препаратов могут выявляться в терапевтической эффективности и в выраженности побочных эффектов. Поэтому проблема выбора наиболее оптимального препарата, как с позиции клинической эффективности и безопасности, так и с позиции стоимости, является весьма актуальной. Осведомленность врачей и пациентов о генериках, как правило хуже, чем об эссенциальных препаратах. Представляется важным и то обстоятельство, что фирмы–производители генерических препаратов могут наделять их особыми, отличающимися от оригинала и других аналогичных препаратов, органолептическими свойствами. Кроме того, некоторые оригинальные препараты не имеют генерических аналогов, что может быть связано с трудностями синтеза вещества, лежащего в основе препарата, не истекшим сроком лицензии и другими причинами.
Все вышеперечисленные факторы затрудняют выбор конкретного препарата для лечения пациентов вообще, и больных с АГ, в частности. В реальных условиях существуют различные принципы выбора, однако преобладают две основные тенденции. Многие врачи, руководствуясь «заботой» о материальном благополучии пациентов отдают предпочтение назначению дешевых лекарственных средств, которые зачастую не соответствуют стандартам GCP и GMP. Другая часть врачей настроена на применение чрезвычайно дорогих препаратов, часто не имеющих реальных клинических преимуществ перед более дешевыми генериками. Поэтому для научно обоснованного, а не интуитивного или эмпирического выбора препарата необходимо проведение клинико–экономических исследований. Их целью является выбор того способа лечения, который оптимально сочетает в себе клиническую эффективность, безопасность и стоимость, а следовательно, является наиболее приемлемым в условиях ограниченного финансирования.
Следует отметить широко распространенные ошибки при проведении сравнительной фармакоэкономической оценки эффективности генерических препаратов. Часто в этом случае используют метод «минимизации затрат». Он позволяет сопоставить затраты при одинаковой клинической эффективности. Поэтому предпринимаются попытки определить наиболее приемлемый с экономической позиции генерический препарат, сравнивая результаты произведения средней дозы, продолжительности назначения и средней цены упаковки препарата по прайс–листу. Очевидно, что такой подход является сомнительным, поскольку принимает во внимание лишь материальную сторону и абсолютно не затрагивает клинических аспектов действия препаратов, хотя, как известно, генерики по клинической эффективности могут иметь существенные отличия. Из–за различий в эффективности еще большей ошибкой является использование такого подхода для сравнения разных групп гипотензивных препаратов.
В г. Волгограде под руководством проф. С.В. Недогоды проводилось открытое рандомизированное исследование по сравнению клинической и фармакоэкономической эффективности препаратов лизиноприла – Диротона (5 мг N 28, Gedeon Richter, Венгрия) и Лизорила (10 мг N 30, Ipca Laboratories, Индия) у пациентов с АГ (по 20 больных в каждой группе). Срок наблюдения составил 6 месяцев. Было показано, что Диротон несколько в большей степени снижал систолическое и диастолическое АД, чем Лизорил, хотя эти различия были статистически недостоверными (табл. 1). Но при этом коэффициент затраты/эффективность у Диротона был в 1,6 раза лучше, чем у Лизорила.
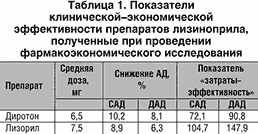
Сравнительное изучение кардиопротективных свойств (регресс гипертрофии миокарда левого желудочка (ГЛЖ)) этих препаратов показало, что Диротон обладал ими в более выраженной степени. С использованием органопротективных показателей в качестве натуральных суррогатных критериев эффективности был проведен их сравнительный фармакоэкономический анализ, который также свидетельствовал в пользу Диротона (рис. 2).
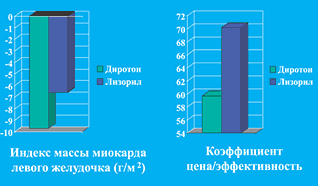
Рис. 2. Стоимость уменьшения ГЛЖ при 6 месячной терапии генериками лизиноприла
В литературе имеется ряд работ по сравнительной эффективности разных ингибиторов АПФ. Так, получены данные сравнительного анализа экономических аспектов лечения двумя ингибиторами АПФ – эналаприлом и лизиноприлом. В исследование было включено 127 пациентов, получавших эналаприл, 52 из которых в течение 12 месяцев продолжили получать эналаприл, а 75 были переведены на лизиноприл (5–20 мг/сут.). Учитывали цену препаратов, административные расходы, затраты на посещение врача, лабораторные исследования, а также стоимость лечения побочных эффектов. Установлено, что в группе пациентов, переведенных на лизиноприл, экономия денежных средств составила от 85 до 110 $ на человека. При этом ежемесячная сэкономленная сумма колебалась от 2,04 до 2,61 $ на пациента. Отмечено также, что сроки появления реальной экономии денежных средств зависят от назначенной дозы лизиноприла и составляют 15 месяцев для 5 мг/сут, 17 месяцев – для 10 мг/сут и 7 месяцев – для 20 мг/сут. Авторы делают вывод о том, что выявление большей экономической эффективности одного препарата по сравнению с другим возможно примерно через 12 месяцев непрерывного лечения. Установлено также, что выполнение программы перехода с терапии каптоприлом на терапию лизиноприлом в соотношении доз 5:1, проводившейся у 109 больных с мягкой и умеренной АГ в течение 4 лет в США, дало экономию в 287231 $.
Хотя ингибиторы АПФ считаются более «дорогим», по сравнению с диуретиками и b-блокаторами, классом препаратов, однако только сравнение эффективности препаратов с учетом их влияния на качество жизни пациентов (стоимостно–утилитарный анализ) позволит выявить реальные преимущества между несколькими препаратами из разных групп. При этом необходимо оговориться, что их нельзя механически переносить на различия между классами в целом. Так, при стоимостном анализе эффективности лечения артериальной гипертензии пропранололом и каптоприлом последний имел значительно худшие показатели экономической эффективности, т.к. оценка проводилась только на основании данных о затратах и продолжительности жизни. В то же время при сравнительной оценке эффективности гипотензивной терапии данными препаратами, проведенной с учетом уровня артериального давления (АД) и показателей КЖ, каптоприл значительно превосходил атенолол в связи с небольшим количеством побочных эффектов и благоприятным влиянием на КЖ.
Кроме того, экономическую эффективность лечения АГ определяет влияние гипотензивных препаратов на сопутствующие заболевания и другие факторы риска сердечно–сосудистых осложнений. Так, М. Johannesson провел оценку рентабельности применения у больных АГ «дорогих» классов гипотензивных препаратов – ингибиторов АПФ и антагонистов кальция. Данные препараты достоверно снижают риск развития ишемической болезни сердца (ИБС). При этом стоимость одного года спасенной жизни колебалась от 50000 до 6000000 шведских крон (1 $ US = 6 шведских крон) в различных анализируемых подгруппах пациентов с АГ. Авторы подчеркивают, что ингибиторы АПФ потенциально являются экономически более выгодными среди определенной группы больных АГ – пациентов с повышенным риском развития ИБС.
J.R. Соok и соавт. представили результаты многоцентрового исследования SOLVD (Studies of Left Ventricular Dysfunction), посвященного оценке соотношения цены и эффективности лечения эналаприлом 1917 больных АГ с дисфункцией левого желудочка. За период наблюдения (в среднем 2,8 года) отмечено достоверное снижение общей смертности и, в результате этого, увеличение средней продолжительности жизни в среднем на 2,14 года. На фоне приема эналаприла выявлено достоверное снижение риска первичной госпитализации из–за сердечной недо статочности на 37% и всех случаев госпитализации на 32%. Это привело к экономии 1656 $ на 1 пациента за весь период лечения. Авторы делают вывод о том, что ингибиторы АПФ и с позиции фармакооэкономики должны использоваться в качестве препаратов первой линии при лечении пациентов с АГ с дисфункцией левого желудочка.
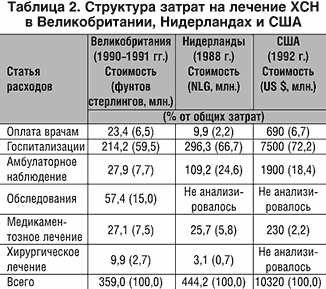
Экономическая эффективность лечения хронической сердечной недостаточности (ХСН) – не менее важная задача кардиологии, поскольку частота ХСН среди лиц старше 45 лет составляет 2,5%, при этом ее распространенность существенно увеличивается с возрастом. Течение ХСН характеризуется частыми повторными госпитализациями на длительный период и высокой летальностью. Ежегодно до 45% больных с ХСН в Великобритании и около 35% – в США нуждаются в стационарном лечении. При этом в США расходы на стационарное лечение больных с ХСН составляют около 9000000000 $ (!), что составляет около 2% всех расходов на здравоохранение [33]. Основная часть расходов на лечение ХСН приходится на оплату стационарного лечения – от 67 до 75% от всех расходов на лечение больных с выраженной ХСН.
Общее число госпитализаций по поводу сердечно–сосудистых заболеваний, хотя и увеличилось за последние 20 лет, все же не в такой степени, в какой число госпитализаций по поводу ХСН. Так, в период с 1979 по 1997 гг. количество больных, выписанных из стационара с основным диагнозом сердечно–сосудистого заболевания (прежде всего, ишемической болезни сердца и АГ), возросло примерно на 20%, в то время, как число больных, выписанных из стационара с основным диагнозом ХСН, почти удвоилось и составило 900000 [38].
Затраты на лечение ХСН зависят от тяжести ХСН в исследуемой популяции. Так, лечение одного больного с ХСН IV функционального класса в течение 1 года во Франции обходится почти в 8 раз дороже, чем лечение одного пациента с ХСН I–II NYHA, а в Голландии и Бельгии лечение больных с ХСН IV функционального класса NYHA в течение 1 года более чем в 30 раз дороже, чем лечение больных I–II функционального класса.
Эти данные позволяют определить основной источник снижения расходов, связанных с лечением пациентов с ХСН: снижение затрат на лечение больных с выраженной ХСН III–IV функционального класса, которые, в свою очередь, зависят от частоты повторных госпитализаций.
Как видно из таблицы 2, в большинстве развитых стран основная часть расходов приходится на оплату стационарного лечения, а затраты на оплату медикаментозных препаратов составляют лишь небольшую часть от общих затрат на лечение больных с ХСН.
Фармакоэкономическая оценка эффективности медикаментозной терапии ХСН базируется на данных рандомизированных клинических исследований, в которых доказана возможность улучшения прогноза пациентов.
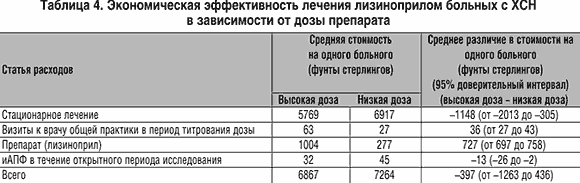
Так, исследование ATLAS (Assessment of Treatment with Lisinopril and Survival) было запланировано и проведено для получения ответа на вопрос, действительно ли высокие дозы (32,5–35 мг) лизиноприла более предпочтительны для снижения заболеваемости и смертности, чем низкие дозы (2,5–5 мг) у больных ХСН.
Были рандомизированы 3164 пациента с сердечной недостаточностью II–IV функциональных классов по NYHA и фракцией выброса Ј30%. С помощью двойного слепого метода изучалось назначение как низких (2,5–5,0 мг ежедневно, n=1596), так и высоких доз (32,5–35 мг ежедневно, n=1568) лизиноприла в течение 39–58 месяцев. Во время данного исследования продолжалась базовая терапия сердечной недостаточности.
Результаты исследования показали, что использование высоких доз лизиноприла снижает комбинированный риск неблагоприятных клинических исходов у пациентов с ХСН на 12% (p=0,002). Количество госпитализаций было значительно ниже в группе высоких доз как по кардиоваскулярным причинам (16% p=0,05), так и по поводу ухудшения течения сердечной недостаточности (24% p=0,002). Аналогичные результаты получены у больных пожилого возраста.
При этом в группе высоких и низких доз не было различий по переносимости, а также отмечено снижение количества госпитализаций и их продолжительности (табл. 3).

Исследование ATLAS убедительно продемонстрироло экономические преимущества высоких доз лизиноприла. Было отмечено небольшое увеличение прямой стоимости в группе высоких доз лизиноприла (стоимость таблеток и трех дополнительных визитов к врачу, необходимых для титрования дозы). Однако из–за существенного снижения расходов на госпитализации (наиболее «затратная» часть лечения ХСН) выявлено снижение общей стоимости лечения на одного больного в группе высоких доз лизиноприла (табл. 4).
Таким образом, выбор оптимального ингибитора АПФ с позиций клинической и фармакоэкономической эффективности позволит повысить эффективность лечения АГ и ХСН и в конечном итоге приведет к экономии денежных средств.
1. Гиляревский С.Р., Орлов В.А. Использование анализа эффективности лечения для принятии клинического решения в кардиологии. Кардиология 1997; 9: 70–80.
2. Flack J.M., Novicov S.V., Ferrario C.M. Benefits of adherence to antihypertensive drug therapy. Europ. Heart J. 1996; 17 (Suppl): 16–20.
3. Drummond M.F. Resource allocation decision in health care: a role for quality of life assessments( J. Chron. Dis. 1987; 40: 605–616.
4. O’Brien B. Principles of economic evaluation for health care programs. J. Rheumatol. 1995; 22: 1399–1402.
5. Bowling A. Research methods in health. Investigating health and health services. Buckinham–Philadelphia: Open University Press. – 1997. – P.79–98.
6. Mark D.B. Economics of treating heart failure. Am. J. Cardiol. 1997;.80: 33–38.
7. Jonsson B. Measurement of health outcome and associated costs in cardiovascular disease. Europ. Heart J. 1996; 17 (Suppl. A): 2–7.
8. Jonsson B.G. Cost–benefit of treating hypertension. J. Hypertens. 1994; 12 (Suppl. 10): 65–70.
9. Kawachi I; Malcolm LA The cost–effectiveness of treating mild–to–moderate hypertension: a reappraisal. J. Hypertens. 1991; 9: 199–208.
10. Bulpitt C.J., Fletcher A.E. Cost–effectiveness of the treatment of hypertension. Clin. Exp. Hypertens. 1993; 15: 1131–1146.
11. Lindgren–Furmaga E.M., Schuna A.A., Wolff N.L., Goodfriend T.L. Cost of switching hypertensive patients from enalapril maleate to lisinopril // Am. J. Hosp. Pharm.– 1991.– Vol.48(2).– P. 276–279.
12. McDonough K.P., Weaver R.H., Viall G.D. Enalapril to lisinopril: economic impact of a voluntary angiotensin–converting enzyme–inhibitor substitution program in a staff–model health maintenance organization // Ann. Pharmacother.– 1992.– Vol.26(3).–P. 399–404.
13. Prasad N., Davey P.G., Watson A.D., Peebles L. Safe withdrawal of monotherapy for hypertension is poorly effective and not likely to reduce health–care costs. J. Hypertens. 1997; 15 (Pt 1): 1519–1526.
14. Pierdomenico S.D., Mezzetti A., Lapenna D., Guglielmi M.D. ‘White–coat’ hypertension in patients with newly diagnosed hypertension: evaluation of prevalence by ambulatory monitoring and impact on cost of health care. Eur. Heart. J. 1995; 16: 692–697.
15. Fonarow G.C., Walden J.A., Livingston N. Cost effectiveness of speciality care for patients with advanced heart failure. J. of Heart Failure. 1996; 3: 149.
16. Meredith P.A. Theraputic implication of drug «holidays». Eur. Heart J. 1996; 17 (Suppl. A): 21–24.
17. Nelson E.C., Stason W.B., Neutra R.R., Solomons H.S. Identification of the noncompliant hypertensive patient. Prev. Med. 1980; 14: 504–517.
18. McCombs J.S., Nichol M.B., Newman C.M., Sclar D.A. The cost of interrupting antihypertensive drug therapy in Medicaid population. Med. Care. 1994; 32: 214–226.
19. Hilleman D.E., Mohiuddin S.M., Lucas B.D., Stading J.A. Cost–minimization analysis of initial antihypertensive therapy in patients with mild–to–moderate essential diastolic hypertension. Clin. Ther. 1994; 16: 88–102.
20. Edelson J.T., Weinstein M.C., Tosteson A.N., Williams L., Lee T.H., Goldman L. Long–term cost–effectiveness of various initial monotherapies for mild to moderate hypertension. JAMA 1990; 19: 407–413.
21. Ramsey S.D., Neil N., Sullivan S.D., Perfetto E А. An economic evaluation of the JNC hypertension guidelines using data from a randomized controlled trial. J. Am. Board Fam. Pract. 1999; 2: 105–14.
22. Peters D.H., Benfield P. Metoprolol: a pharmacoeconomic and quality–of–life evaluation of its use in hypertension, post–myocardial infarction and dilated cardiomyopathy. Pharmacoeconomics 1994; 6:370–400.
23. Peters DH, Benfield P. Metoprolol: a pharmacoeconomic and quality–of–life evaluation of its use in hypertension, post–myocardial infarction and dilated cardiomyopathy. Pharmacoeconomics 1994;6: 370–400.
24. Garg R., Yusuf S. Epidemiology of congestive heart failure. In: Barnett D., Pouler H., Francis G., editors. Congestive cardiac heart failure. Pathophysiology and treatment. New York: Marcel Dekker, 1993: 9–25.
25. McKee PA, Castelli WP, McNamara PM, et al. The natural history of congestive heart failure: The Framingham Study. N.Engl.J.Med. 1971; 285: 1441–6.
26. Yancy CW, Firth BG. Congestive heart failure. Dis.Mon. 1988; 34 (8); 465–536.
27. Ryden–Bergsten T., Andersson F. The health care costs of heart failure in Sweden. J. Intern. Med. 1999; 246: 275–284.
28. McMurray J., Hart W., Rhodes G. An evaluation of the cost of heart failure to the National Health Service in the UK. Br. J.Med. Econ. 1993;6: 91–98.
29. Rich MW., Beckham V., Wittenberg C. et al. A multidisciplinary intervention to prevent the readmission of elderly patients with congestive heart failure. N.Engl.J.Med. 1995; 333:1190–1195.
30. Shulman KA, Buxton M., Glick HA Results of the economic evaluation of the FIRST study: a multicentral prospective economic evaluation. Int J. Technol Assess Health Care 1996; 12: 698 – 713.
31. American Heart Association. 1999 Heart and stroke: statictical update. Dallas.
32. Malek M. Health economics of heart failure. Heart 1999; 82 (suppl. IV): IV11–IV13.
33. Гиляревский С.Р., Орлов В.А., Сычева Е.Ю. Фармакоэкономика хронической сердечной недостаточности: клинические аспекты. – 2001 – Москва. – С.19–33.
34. Packer M. et al. Comparative effects of low and high doses of lisinopril on morbidity and mortality in chronic heart failure. Circulation, Dec 1999; 7
Ключевые слова статьи: эффективности, сердечной, недостаточности, ингибиторов, артериальной
Авторы: Мамаев В.И., Недогода С.В., Остроумова О.Д., Шорикова Е.Г.
.png)